Affilogic is a private biotech company specialized in discovering and developing Nanofitins® through early-stage collaborations with worldwide industry leaders in the pharmaceutical sector.
These affinity proteins can be designed as targeted inhibitors, or as vectors for specific addressing of cells and tissues. Affilogic follows the science to any therapeutic area as long as an innovative Nanofitin-based biotherapy can make a difference to meet patients’ needs. Usual systemic routes can be travelled by Nanofitins®, but their intrinsic properties make them amenable to other routes, such as oral route and pulmonary delivery.
To learn more about the use of Nanofitins® as affinity ligands for the purification of biologics, you can visit the dedicated Affichrom’ website.

Affilogic wants to hear from you!
World Vaccine Congress Washington 2024

Come and meet us at the World Vaccine Congress Washington – USA
Apr 1-4, 2024
WORLD ADC London

Come and meet us at the 14th WORLD ADC London – UK
Mar 12-15, 2024
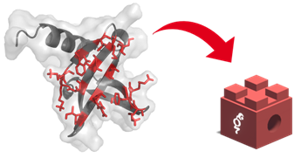
Technology
Each Nanofitin® is 20 times smaller than an antibody and demonstrates hyper stability. Their simple protein scaffold is particularly fitted for combination.
Read More
Your Nanofitins®
We generate Nanofitins® for our partners, on a target by target basis, and combine them with each other or with other biomolecule to design an ideal targeted molecule.
Read More
Our platforms
We have developed platforms with readily available Nanofitins® to empower our partner’s molecule: half-life extension, BBB-crossing…
Read More


